Capitulo VIII ¿Cuánto?
Cuando todos parecían haberse olvidado de los rayos uránicos, una joven polaca graduada en Física y Matemáticas por la Sorbona, que acababa de tener una niña y estaba casada con un científico desclasado, se interesó por ellos. Y, según se dice, allí donde la aproximación física de Becquerel fracasó, triunfó la aproximación química de Marie. Sin embargo, la historia no fue tan simple. No hay duda de que el principal éxito de Marie fue poner a punto un método eficiente de separación de los nuevos elementos químicos. Pero para llegar al descubrimiento de los mismos tuvo que hacer infinitas medidas «físicas» de la carga eléctrica producida por los rayos, mediciones que también intentó Becquerel, aunque sin éxito. Es decir, que no triunfó la química donde había fracasado la física, sino que triunfó el genio creativo y el tesón de Marie. También fue determinante su aproximación al estudio del fenómeno libre de los prejuicios que podrían haberla atenazado si hubiera abordado un tema de investigación «heredado», como fue el caso de Becquerel. Y posiblemente, por encima de todo, fue decisiva la energía de la juventud de Marie, que tenía todo por demostrar, mientras que el maduro Becquerel ya tenía poco que ganar.
De entrada, Marie no se preguntó por la naturaleza del fenómeno, sino que intentó responder a preguntas aparentemente más modestas: ¿cuál era la magnitud de los rayos uránicos?, ¿qué sustancias la presentaban? Su gran éxito fue que consiguió respuestas acertadas para ambas cuestiones. Para ello necesitó grandes dosis de osadía, una disciplina de trabajo férrea y algo de suerte. No hay que olvidar que realizó todo este trabajo a cambio de nada, pues no recibió remuneración alguna por el mismo.
Lo primero que tuvo que hacer el matrimonio Curie tras elegir el objetivo de la investigación fue encontrar un lugar donde Marie pudiera trabajar. Charles Gariel, el nuevo director de la Escuela de Física y Química Industriales, permitió, como su antecesor, que Marie trabajara en sus instalaciones, a pesar de que la investigadora no tenía ninguna vinculación profesional con la Escuela. Se decidió que para sus experimentos usaría de forma exclusiva un cobertizo de madera acristalado, que había sido almacén y sala de máquinas. El improvisado laboratorio tenía goteras y grietas en las paredes, y su único mobiliario eran unas desnudas mesas de madera. Además, no tenía más sistema de calefacción que una vieja estufa que lo llenaba todo de hollín, por lo que el cobertizo era un nevero en invierno y un homo en verano. En el patio anejo se podían realizar al aire libre las operaciones químicas que requerían una mayor ventilación, pues las instalaciones no contaban con campanas extractaras de gases ni con ningún mecanismo de ventilación. Marie y Pierre no podían aspirar a nada mejor, pero contaban con lo imprescindible para desarrollar su proyecto: la firme decisión de realizarlo.
¿CUÁNTO?
Antes de comenzar a estudiar los rayos uránicos, Marie ya había decidido que la impresión de películas fotográficas era un método de análisis poco preciso, ya que ella quería medir la intensidad de los rayos y comparar la cantidad de radiación emitida por distintas sustancias. Según había determinado Becquerel, sabía que los rayos tenían la capacidad de ionizar el aire (es decir, de convertirlo en un conductor de la electricidad), por lo que si conseguía un dispositivo lo suficientemente sensible para medir las pequeñas corrientes eléctricas generadas en el aire ionizado podría cuantificar los rayos.
La tarea era difícil porque las corrientes eran extraordinariamente pequeñas, por lo que Marie buscó dispositivos más precisos que el electrómetro empleado por Becquerel. Contaba, sin embargo, con la balanza de cuarzo construida por Pierre y su hermano Jacques, la cual hacía uso del efecto piezoeléctrico descubierto por ambos en 1880. Marie la empleó en un dispositivo diseñado y construido con ayuda de Pierre, el cual contaba además con el electrómetro de cuadrantes y una cámara de ionización conectada a una batería. Un esquema del mismo se muestra en la figura adjunta.
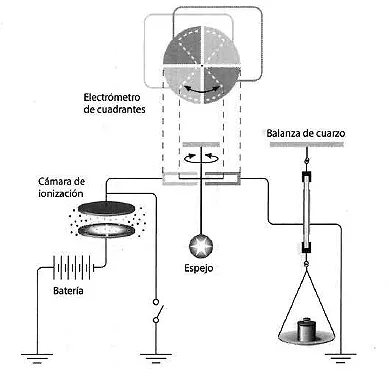
La sustancia radiactiva se colocaba en la cámara de ionización, donde los rayos que emitía ionizaban el aire y los iones se desplazaban atraídos por los polos de una batería que se conectaba a la cámara, produciendo en ella una corriente. Esta cargaba el electrómetro desviando la aguja del mismo. Marie compensaba la carga del electrómetro con la carga suministrada por un cuarzo piezoeléctrico sometido a la tracción o la compresión producidas quitando o poniendo peso en la balanza conectada al mismo. La actividad de cada sustancia se determinaba midiendo con un cronómetro el tiempo que tardaba en producir «saturación», es decir, cuando no se transmitía más carga a través del aire. Marie tenía que cronometrar el tiempo que cada sustancia tardaba en llegar a la saturación mientras añadía o quitaba de la balanza pesas hasta que la aguja del electrómetro volvía a su posición inicial. De este modo, se podía decir que Marie «pesaba» la radiactividad.
El procedimiento real debió de ser bastante complejo, por más que Marie dijera que llegó a hacerlo de forma automática. Según contó su nieta Hélène Langevin-Joliot, a finales del siglo XX nadie en el Laboratorio Curie era capaz de emplear el dispositivo utilizado por su abuela (el cual en la actualidad se halla en el Museo Curie). Sin embargo, con el primer prototipo, construido con materiales de desecho de los talleres de la Escuela de Física y Química Industriales, Marie realizó miles de medidas de la intensidad de los rayos uránicos. Las fotos que muestran a Marie en el laboratorio sentada en una mesa y mirando a través de un pequeño visor corresponden al empleo de este dispositivo. Con él comprobó qué sustancias emitían rayos uránicos y midió con gran precisión la intensidad de los mismos detectando corrientes extraordinariamente pequeñas, de diez billonésimas de un amperio (0,00000000001 A = 10−11 A). Para tener una idea de la sutileza de tales corrientes, recordemos que, por ejemplo, pequeños electrodomésticos tales como una máquina de afeitar funcionan con corrientes de 0,5-1,0 amperio.
¿QUÉ SUSTANCIAS?
Tras haber puesto a punto y comprobado la precisión del instrumento para cuantificar la radiactividad, Marie se planteó identificar las sustancias que emitían los rayos uránicos, pues pensó que —tal y como reflejó en su tesis doctoral— «era muy improbable que la radiactividad considerada como una propiedad atómica fuera exclusiva de un único tipo de sustancias excluyendo todas las demás».


FOTO SUPERIOR: Marie usando el electrómetro, con Pierre y Gustave Bémont en el laboratorio de la Escuela.
FOTO INFERIOR: El interior del laboratorio de la Escuela de Física y Química Industriales donde Marie realizó su tesis.
Marie empezó midiendo todos los elementos puros entonces conocidos, tanto los metálicos como los no metálicos, así como las aleaciones que había en el laboratorio de la Escuela de Física y Química Industriales. Uno de los primeros elementos que estudió fue el fósforo, del cual deriva el nombre del fenómeno, la «fosforescencia» que atrajo el interés de Antoine Becquerel. Marie también midió el uranio puro y, a continuación, estudió todos los minerales del Museo de Historia Natural de Francia, los cuales le fueron suministrados por el geólogo encargado de la colección, Alfred Lacroix. Esta fue una de las intuiciones más geniales de su trabajo: al no limitarse al estudio de compuestos puros sintetizados en el laboratorio, cuya composición química es conocida con gran precisión, tuvo ocasión de descubrir «nuevos cuerpos radiactivos».
El primer resultado sorprendente que obtuvo Marie fue que la emisión de los rayos de Becquerel no era una propiedad exclusiva del uranio y sus sales, sino que también la presentaba otro elemento, el torio. Por lo tanto, los rayos de Becquerel no podían seguir llamándose «rayos uránicos»: ¿habría que llamarlos «uránico-tóricos» tal vez? Marie envió entonces como única autora un informe con sus primeras conclusiones a la Academia de Ciencias francesa, el cual fue presentado en su nombre por el profesor Lippmann el 12 de abril de 1898.
Otro hecho relevante observado por Marie, y que confirmaba lo que ya había indicado Becquerel, fue que los rayos eran una propiedad intrínseca que presentaba el elemento, independientemente de la temperatura a la que se encontraba, de si estaba puro o formando compuestos y de si era irradiado o no. No se trataba de una propiedad química de una sustancia, como la fosforescencia presentada por muchos minerales, sino de un fenómeno completamente nuevo, característico del átomo. Como estaba haciendo una cuantificación precisa, observó que la intensidad de los rayos era proporcional a la cantidad del uranio presente en las muestras, por lo que la mayor actividad la presentaban las muestras de uranio puras.
EL INASIBLE POLONIO
Sin embargo, el resultado más sorprendente que había obtenido Marie no aparecía en su primer informe. Lo anotó por primera vez en su diario de laboratorio el 17 de febrero de 1898: dos de los minerales de uranio que había estudiado, la chalcolita y la pechblenda, eran tres o cuatro veces más activos que el uranio puro. Estos resultados contradecían la observación anterior de que la actividad era proporcional a la cantidad de uranio. Repitió los experimentos y revisó el funcionamiento y la precisión de sus aparatos de medición, comprobando que todo estaba bien. Entonces sintetizó el principal componente de la chalcolita, el sulfato de cobre y uranilo, a partir de compuestos químicamente puros y midió su actividad: era la que cabía esperar dado su contenido en uranio. Ello significaba que la actividad de exceso de la pechblenda debía tener otro motivo, «algo» nuevo y desconocido, presente en el mineral, pero no en el compuesto que había sintetizado Marie. Tras obtener este resultado, contó con un colaborador de excepción, tal y como recordó ella misma en sus Notas autobiográficas:
Al formular hipótesis sobre las razones para ello, solo se me ocurrió una explicación: aquellos minerales debían contener alguna sustancia desconocida muy activa. Mi marido estuvo de acuerdo, así es que le apremié para que buscáramos juntos la hipotética sustancia, ya que si sumábamos esfuerzos obtendríamos resultados antes.
Aunque Pierre discutía con Marie todos los resultados que ella iba obteniendo y debió de tener un papel fundamental en el diseño y construcción del aparato de medición, hasta ese momento había seguido con sus estudios de simetría. Sin embargo, el día 18 de febrero comenzó a hacer sus entradas en el diario de laboratorio de Marie: había decidido abandonar sus propias investigaciones para dedicarse por entero a trabajar con Marie.
LOS DIARIOS DEL DESCUBRIMIENTO

A pesar de lo escuetos que son, el estudio de los llamados «diarios del descubrimiento» es muy interesante. Una de las mejores transcripciones la hizo la hija de Marie, Irène, que entendía perfectamente la forma de anotar de su madre, pues durante muchos años trabajaron juntas en el laboratorio. De entrada, son una prueba irrefutable de la peligrosidad del laboratorio en el que trabajaron los Curie: hoy en día siguen siendo tan radiactivos que no se pueden manejar sin protección. Otra de las cosas que se deduce de su estudio es que Marie y Pierre trabajaban en equipo, de forma que en su época más fructífera no se puede decir qué experimentos hacía uno y qué experimentos hacía el otro; los dos hacían de todo, trabajaban como una sola persona con dos cerebros y cuatro manos. En la ilustración puede verse una página de los diarios de laboratorio de los Curie, la fechada el 22 de abril de 1902; la parte superior, escrita por Pierre, muestra una medida del peso atómico del radio = 223,3 (finalmente propusieron el valor de 225), mientras que en la parte inferior aparecen anotaciones de Marie indicando la masa de cloruro de plata obtenida por precipitación del cloruro, dato a partir del cual determinó el peso atómico del radio, suponiendo que su fórmula era RaCl2
Con objeto de identificar las causas de la extraordinaria actividad, Marie y Pierre tenían que procesar la pechblenda de una forma diferente a como se había hecho hasta entonces, pues en lugar de buscar el uranio buscaban sustancias nuevas de las cuales solo tenían indicios de su existencia por los rayos que emitían. La pechblenda era un mineral natural que, además de los óxidos de uranio, los compuestos mayoritarios, tenía otras muchas sustancias en pequeñas cantidades, hasta sumar un total de 30 elementos químicos diferentes. Para realizar el análisis químico de la pechblenda solicitaron la ayuda de Gustave Bémont, profesor encargado del laboratorio de la Escuela de Física y Química Industriales. Bémont los debió instruir en el empleo del método clásico de identificación y separación de cationes a través de análisis cualitativo por vía húmeda, método empleado en los laboratorios europeos, que había sido puesto a punto por el químico alemán Carl R. Fresenius sesenta años antes.
Así pues, Marie y Pierre emplearon el método químico de separación de cationes por precipitaciones sucesivas de sulfatos, sulfuros, hidróxidos y cloruros. Pero lo combinaron con el novedoso método físico de medir en cada fracción la intensidad de los rayos emitidos. Partiendo de la pechblenda que les habían suministrado en el laboratorio de la Escuela, que era tres veces más activa que el uranio, obtuvieron una sustancia 17 veces más activa. Repitiendo el ciclo de separación química en las fracciones que emitían rayos, obtuvieron finalmente una sustancia cuya actividad era 400 veces superior a la del uranio.
A partir de esos resultados los Curie lanzaron su hipótesis más atrevida en un informe presentado ante la Academia de Ciencias francesa el 18 de julio de 1898 por Henri Becquerel, ya que ni Marie ni Pierre eran miembros de la misma. En su título aparecía una palabra nueva que había sido acuñada por Marie, radiactividad, vocablo de raíz latina que significa «que emite rayos». En su informe afirmaban que de la extraordinaria actividad mostrada por la chalcolita y la pechblenda deducían que contenía un nuevo elemento mucho más activo que el uranio, para el que proponían el nombre de polonio «en memoria del país de uno de nosotros».
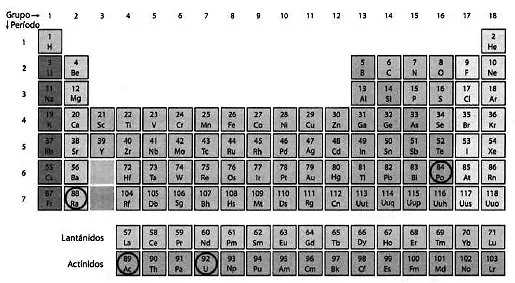
Tabla periódica de los elementos mostrando el radio en el grupo 2, el polonio en el 16 y el uranio y el actinio en los actínidos.
Pero la sustancia cuya actividad era 400 veces superior a la del uranio, aún no era el nuevo elemento o una de sus sales puras; todavía tenía una gran cantidad de bismuto, elemento químico del grupo del nitrógeno, cuyas propiedades eran muy similares a las del nuevo elemento. Por ello Marie y Pierre supusieron que el polonio se encontraba en el mismo grupo de la tabla periódica que el bismuto. Pero, a diferencia del nuevo elemento tan parecido a él, el bismuto no era radiactivo. La radiactividad fue la propiedad en la que los Curie se basaron para proponer la existencia del polonio.
RADIO: UNA BÚSQUEDA INTERMINABLE
Tras este deslumbrante descubrimiento, Marie y Pierre se fueron de vacaciones y no retomaron el tratamiento de la pechblenda hasta noviembre de 1898. Para su sorpresa, encontraron que había una especie radiactiva cuyas propiedades químicas eran completamente distintas a las del polonio, aunque tenía en común con él que era mucho más activa que el uranio. Ello no podía deberse más que a la existencia de otro nuevo elemento, que debía encontrarse también en cantidades muy pequeñas, pues los análisis previos de la pechblenda no lo habían puesto de manifiesto. No obstante, sus propiedades eran mucho más parecidas a las del bario, uno de los metales del grupo de los alcalinotérreos de la tabla periódica. Para aislar este nuevo elemento siguieron un procedimiento similar al empleado para aislar el polonio, que consistía en disolver el sólido con ácidos y luego precipitar las distintas sales. Tras cada una de las separaciones se medía la radiactividad de cada fracción con el fin de seguir la pista al elemento buscado. Así obtuvieron una mezcla de cloruros de bario y del nuevo elemento que era 900 veces más activa que el uranio.
Para tener un dato más que confirmara su existencia y ayudara a su identificación, enviaron varias muestras al físico Eugène Demarçay, que registró su espectro de emisión y buscó la presencia de líneas no atribuibles a ningún elemento conocido. Demarçay observó unas nuevas líneas en la zona ultravioleta, cuya intensidad aumentaba a medida que aumentaba la radiactividad de la sustancia, por lo cual las atribuyó al nuevo elemento. Marie y Pierre Curie y Gustave Bémont enviaron una nueva comunicación a la Academia de Ciencias francesa el 19 de diciembre de 1898 en la que denominaban al nuevo elemento como «radio».
«La nueva sustancia radiactiva contiene todavía una gran proporción de bario; a pesar de ello, la radiactividad es considerable. La radiactividad del radio puro debe ser enorme».
—SORAYA BOUDIA, MARIE CURIE ET SON LABORATOIRE.
En una entrevista que concedió veinte años después, Bémont todavía se mostraba emocionado por la deferencia de Pierre al hacerlo coautor del descubrimiento del radio. En ella contaba que se sintió muy orgulloso por haber recibido tal honor, pero que no creía merecerlo, pues no había tenido un papel activo en el descubrimiento del radio. Bémont afirmaba que él simplemente había hecho un favor a un colega, aconsejándole en el diseño y puesta a punto de los métodos de separación química. Esta entrevista contradice las teorías de algunos historiadores de la ciencia, singularmente el norteamericano Lawrence Badash, el más reconocido experto en historia de la radiactividad, el cual, incrédulo ante la capacidad de Marie para llevar a cabo el método de separación química, atribuía a Bémont todo el mérito de esta parte tan significativa de la tesis de la investigadora.
Pero más allá de la ayuda que Bémont pudiera prestar a Marie, lo cierto es que ninguno de los tres científicos inventó nada nuevo en química, porque el método de Fresenius era ya antiguo cuando lo empleó Marie. También era conocida la capacidad de ionizar el aire de las sales de uranio, así como el funcionamiento de los electrómetros y la piezoelectricidad. Pero fue Marie la que empleó todo ello para descubrir un nuevo fenómeno y fue ella quien se las ingenió para convencer al mundo de la relevancia de su descubrimiento.
Marie había comenzado su tesis doctoral un año antes y ya se había atrevido a proponer la existencia de dos nuevos elementos químicos. Su osadía era tal que hizo estas propuestas basándose en un hecho sin precedentes: empleó la radiactividad de estos elementos como prueba fundamental de su existencia. Hay que recordar que este fenómeno lo había descubierto Becquerel apenas un par de años antes y que el nombre se lo acababa de dar Marie. El hecho de usar la radiactividad se debía a que en el momento de proponer la existencia de los nuevos elementos, Marie y Pierre no podían aportar las pruebas de verificación de su descubrimiento exigidas por las sociedades químicas de la época. Estas pruebas eran la identificación de nuevas líneas en el espectro de emisión, la determinación del peso atómico y la aportación de una pequeña cantidad del elemento puro. En el momento de alegar el descubrimiento de ambos elementos solo pudieron aportar una de las pruebas de la existencia de uno de ellos, el espectro del radio.
En realidad, Marie contaba con otras evidencias: empleó el método radioquímico, es decir, midió la emisión específica de un elemento radiactivo. Ese método se emplea hoy para desentrañar procesos fisicoquímicos o biológicos en campos tan dispares como la cinética química, la arqueología (para la datación mediante carbono-14) o la geología, proporcionando resultados inaccesibles por cualquier otro método. Muchas de estas ciencias no existían cuando Marie inventó el método, pero ella intuyó que había descubierto un campo científico en el que aparecerían nuevas herramientas de análisis. En su tesis constató de forma orgullosa que el método que ella había usado para detectar los nuevos elementos era miles de veces más sensible que la espectroscopia con la cual había confirmado la existencia del radio.
Tras proponer su existencia, Marie se dedicó a intentar aislar los nuevos elementos puros, lo que iba a suponer un trabajo mucho mayor de lo que imaginó en un principio, porque los nuevos elementos radiactivos se encontraban en la pechblenda en proporciones extraordinariamente pequeñas. Más adelante se comprobaría que se encontraban en una proporción inferior a uno en diez millones. Aunque los Curie aún no conocían ese dato, era evidente que necesitarían grandes cantidades del mineral que los contenía.
Por ello, desde que intuyeron la existencia de dos nuevos elementos con propiedades singulares, Marie y Pierre comenzaron a buscar fuentes de pechblenda, la principal mena del uranio que los contenía a ambos. Las mayores reservas europeas de este mineral se encontraban en las minas de Joachimsthal, en Bohemia, que en aquella época formaba parte del Imperio austrohúngaro (hoy, con el nombre de Jachymov, forman parte de la República Checa). De estas minas se extraían las sales de uranio que se empleaban en Europa para colorear el vidrio. Pero la compra de las cantidades del mineral puro que necesitaban representaba un coste que los Curie no podían pagar. Marie no solo no cobraba por su trabajo de investigación, sino que tampoco recibía ninguna financiación para desarrollarlo. Pero hubo un hecho afortunado que sacó al matrimonio del callejón sin salida al que lo había llevado su falta de fondos. Tras procesar la pechblenda que inicialmente obtuvo en el laboratorio de la Escuela, Marie había llegado a la conclusión de que los restos del mineral que quedaban tras haber extraído el uranio debían contener todo el radio y una gran parte del polonio presentes en el mineral. Por suerte para Marie y Pierre, estos restos de mineral no tenían valor comercial y se amontonaban por toneladas en las afueras de la mina.
FECHADO CON CARBONO-14
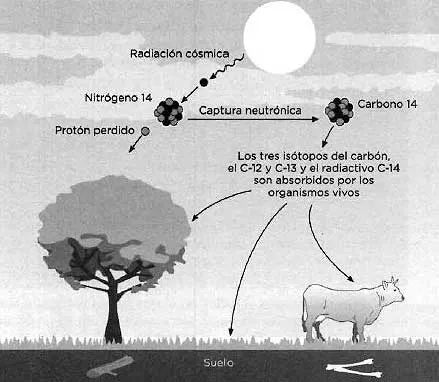
Los isótopos del carbono de números másicos 12 y 13 son los más abundantes y no sufren procesos de desintegración radiactiva (concepto analizado con detalle en el capítulo siguiente). Hay un isótopo adicional muchísimo menos abundante, el carbono-14 (14C), cuya abundancia natural es 0,00000000012 %. Se genera en un proceso de captura neutrónica por la acción de los rayos cósmicos sobre el nitrógeno de la atmósfera:
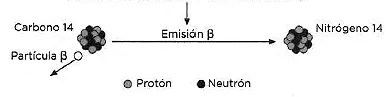
y sufre un proceso de desintegración espontánea emitiendo una partícula β y un antineutrino (indetectable a efectos prácticos):
Dado que las reacciones de formación y desintegración tienen lugar constantemente, existe un equilibrio que se traduce en que la proporción de 14C es aproximadamente constante en la atmósfera. Las plantas toman el 14C del CO2 de la atmósfera a través de la fotosíntesis, y de ahí pasa a los animales herbívoros y, de ellos, a los carnívoros. Por esta causa todos los seres vivos mantienen la proporción de 14C constante. Aunque esta proporción es muy pequeña, mientras un animal o planta están vivos dan lugar a 15,3 desintegraciones por minuto y por gramo. No obstante, cuando mueren, el 14C sigue desintegrándose, siempre a la misma velocidad, disminuyendo su proporción respecto al contenido total de carbono. Al cabo de miles de años, midiendo la proporción de 14C, se sabe cuándo murió el animal o la planta. Por ejemplo, midiendo la cantidad de carbono-14 que hay en una momia egipcia puede determinarse cuándo murió la persona momificada. El período de semidesintegración del 14C es de 5700 años aproximadamente, por lo que se emplea para identificar objetos orgánicos no muy recientes, cuyas edades lleguen hasta 50 000 años. Objetos demasiado recientes en relación al período de semidesintegración del 14C aún no presentan una caída significativa de su concentración inicial, mientras que objetos cuya antigüedad es superior a unos diez períodos de semidesintegración implican una proporción demasiado baja, lo cual se traduce en ambos casos en márgenes de error demasiado grandes.
Tras la muerte y descomposición, la madera y los huesos pierden C-14, que se transforma en N-14 por una emisión β.
A través de sus contactos en la Academia de Ciencias francesa se dirigieron a sus homólogos de la Academia vienesa, y de ellos recibieron un primer envío de 5 kg de estos residuos, en los que comprobaron su hipótesis. Posteriormente les enviaron otros 100 kg. No obstante, dada la bajísima concentración de polonio y radio en el mineral, estas cantidades eran totalmente insuficientes para obtener una masa de los nuevos elementos lo suficientemente grande como para realizar su análisis e identificación. Necesitaban toneladas del residuo del mineral, lo que planteaba un nuevo problema económico, pues, aunque el material no tenía coste, los Curie habían de pagar el transporte.
Marie tuvo que ajustar aún más el presupuesto familiar, pero a mediados de 1898 tuvo un ingreso inesperado: la Academia de Ciencias de París le concedió el premio Gegner por su estudio de las propiedades magnéticas de los aceros y por sus incipientes trabajos sobre la radiactividad. El premio tenía una dotación económica de 3800 francos, lo cual era una cantidad considerable para la época. Aunque este premio Gegner (el primero de los tres de este tipo que se le concedieron y también el primero de la larga serie de reconocimientos que recibió a lo largo de su vida) se lo otorgaron exclusivamente a ella, los miembros del jurado consideraron más apropiado dirigirle la carta de concesión a su marido.
En octubre de 1898 Marie anotó en su cuaderno de gastos un pago por concepto de transporte desde Joachimsthal. El primer cargamento, un montón de sacos llenos de un polvo marrón y agujas de pino, se apiló en el patio de la Escuela de Física y Química Industriales de París. A comienzos del siglo XXI la radiactividad de su pavimento sigue siento tan alta que la zona no es apropiada ni para construir un aparcamiento. Para procesar esta ingente cantidad de material, Marie tuvo acceso a una nueva dependencia aún más deteriorada que el taller en el que había realizado los primeros experimentos de su tesis, una especie de hangar que en su día había sido dedicado a sala de disección.
UN TRABAJO ÉPICO
Aunque los planes iniciales eran aislar los dos elementos, tras muchos esfuerzos tuvieron que abandonar el polonio y dedicarse solo al radio. A partir de sus experimentos previos habían llegado a la conclusión de que su química era más simple, por lo que debía de resultar más fácil de aislar. Pero había un factor adicional que convertía al polonio en un elemento inaprensible. Además de encontrarse en una bajísima concentración, parecía desaparecer, evaporarse. Como se supo mucho después, el polonio se desintegraba, se descomponía, dando lugar a plomo. El radio sufría un proceso similar, pero mientras que en el radio se desarrollaba a lo largo de miles de años, el del polonio requería poco más de cien días. Por si eso no fuera suficiente, la concentración de polonio era 4000 veces inferior a la de radio. Por ese motivo el polonio no se dejó atrapar por Marie. A pesar de ser menos complejo, el aislamiento del radio tampoco era fácil. Con el tiempo se descubriría que tres toneladas de uranio no contenían más que un gramo de radio. Esas proporciones venían determinadas por el propio fenómeno de la radiactividad, porque como ya se ha indicado tanto el radio como el polonio se desintegraban dando lugar a otros elementos.


FOTOS SUPERIORES: Dos fotografías de Pierre y Marie Curie: en el laboratorio de la Escuela y posando para el fotógrafo.
FOTO INFERIOR: Cobertizo anejo al laboratorio de la Escuela de Física y Química Industriales donde Marie realizó sus experimentos sobre la radiactividad.
El trabajo que realizó Marie en aquel hangar, que tenía tantas goteras que se le contaminaban las disoluciones cuando llovía, posee tintes épicos. Allí procesó toneladas del material que le llegó de Joachimsthal, tratándolo en porciones de 20 kg que calentaba en enormes calderos que removía con una gran barra de hierro. Era un extenuante trabajo físico realizado en unas circunstancias deplorables, las cuales, paradójicamente, pudieron salvarle la vida. En efecto, el escaso aislamiento del hangar donde Marie trabajaba y el hecho de que algunas veces lo hiciera incluso en el patio al aire libre, la libró de aspirar parte de los gases tóxicos que se desprendían en el proceso, tanto los vapores de los ácidos y las bases que usaba en el tratamiento como el gas radón radiactivo que se producía por la desintegración del radio, como se descubriría mucho después. Aunque el esfuerzo físico debió de ser extraordinario —y, al principio, realizado casi en solitario—, lo relevante del mismo fue el genio químico de Marie, que combinó esa investigación con las medidas de conductividad. A pesar de las durísimas condiciones de trabajo, Marie declaró haberse encontrado inmensamente feliz en esa época:
En aquella época estábamos volcados por completo en el nuevo ámbito que había desvelado un descubrimiento tan inesperado. A pesar de los contratiempos de nuestras condiciones de trabajo, éramos dichosos. […] En ocasiones, al anochecer, después de cenar, regresábamos al hangar para echar un vistazo a nuestro dominio. Nuestros preciosos productos que no podíamos resguardar de las inclemencias del tiempo, estaban dispuestos sobre mesas y tablas; desde todas partes se veía su silueta, de una tenue luminosidad; aquellos fulgores que parecían suspendidos en la oscuridad, nos llenaban de alborozo.
El proceso de separación para la extracción del uranio del mineral que se llevaba a cabo en la mina consistía en machacar la pechblenda hasta reducirla a polvo, mezclarla con carbonato de sodio y «tostarla», es decir, calentarla al aire. Esta mezcla sólida se trataba con ácido sulfúrico diluido para extraer en la fase acuosa el sulfato de uranilo y sodio, que era la parte que se aprovechaba del mineral. El residuo marrón insoluble se descartaba y se tiraba en el bosque de pinos cercano. Ese sólido es lo que llegó al patio de la Escuela de Física y Química Industriales de París.
Marie comenzó por hervir este polvo marrón en una disolución que contenía carbonato sódico, en la cual se disolvían los carbonatos de aluminio, plomo, calcio y sodio, quedando un precipitado que contenía carbonatos y sulfatos de metales alcalinotérreos y de los elementos radiactivos. Este precipitado se trataba con ácido clorhídrico, que extraía en la fase acuosa los cloruros solubles, dejando un precipitado de los sulfates insolubles, entre ellos el de radio. A la disolución que contenía los cloruros se le añadía ácido sulfhídrico, lo que daba lugar a un precipitado de sulfuros que contema a su vez el de polonio. A la disolución que quedaba tras separar el precipitado de sulfuros, se le añadía amoniaco para hacerla más básica (aumento del pH), lo cual hacía que precipitaran los hidróxidos insolubles. Poco después se encontraría en estos hidróxidos un nuevo elemento radiactivo, el actinio. Por cada tonelada de residuo de pechblenda recibida de Joachimsthal, Marie obtuvo entre 10 y 20 kg de sulfatos de alcalinotérreos, que incluían una pequeña proporción del sulfato de radio.
En ese precipitado de sulfatos se repetía el proceso de formación de carbonatos, cloruros, sulfuros e hidróxidos, y de ahí se obtenía una disolución de cloruro de calcio, que era descartado, y un precipitado de cloruro de bario que tenía una pequeña cantidad del de radio. Como el bario y el radio poseían unas propiedades químicas muy parecidas, la única forma de separarlos era mediante cristalización fraccionada. Para realizarla había que calentar hasta la ebullición el precipitado que contenía la mezcla de los dos cloruros con la cantidad justa de agua destilada necesaria para su disolución. Al enfriar lentamente esta disolución, precipitaban primero unos «hermosos cristales» de cloruro de radio, según recogería Marie en su tesis, debido a que el cloruro de radio era un poco menos soluble que el de bario. Este proceso era el más delicado, porque enseguida empezaba la precipitación del cloruro de bario y antes había que extraer los diminutos cristales del cloruro de radio.
«La espontaneidad del rayo es un enigma. ¿Cuál es la fuente de energía de los rayos de Becquerel? ¿Hay que buscarla en los cuerpos radiactivos o en el exterior?».
—PIERRE RADVANYI, LES CURIE.
Dada la similitud entre los cloruros de bario y de radio, este último no se obtenía puro en la primera cristalización, por lo que había que repetir el proceso de cristalización tantas veces como fuera necesario mientras siguiera aumentando la radiactividad. En la muestra más pura, esta llegó a ser un millón de veces superior a la del uranio. A partir de la muestra de cloruro de radio más activo, que era también el más puro, Marie determinó el peso atómico del radio, midiendo la cantidad de cloruro mediante el método gravimétrico de precipitación de cloruro de plata. Para obtener a partir de ese valor el peso atómico del radio tuvo que hacer una suposición adicional: que la estequiometría era igual a la del bario. Es decir que había dos átomos de cloro por cada átomo de radio. Como el bario (peso atómico 137) es mucho más ligero que el radio, el peso que fue obteniendo para este último fue subiendo conforme mejoró su método de aislamiento, obteniéndolo cada vez más puro.
Durante todo este proceso Marie trabajaba a ciegas, le seguía la pista a elementos fantasma que formaban compuestos de propiedades desconocidas, en cantidades extraordinariamente pequeñas. Aparte de su intuición, la principal orientación que le indicaba que iba en el buen camino era la radiactividad, que debía medir en cada fracción de disolución o precipitado que obtenía en cada una de las fases del proceso empleando la balanza de cuarzo.
Pero además de todas esas dificultades, había algo muy desconcertante. Usualmente, en los minerales se encuentran juntos elementos de reactividad química similar, es decir, que ocupan posiciones contiguas en la tabla periódica. Por ejemplo, los mencionados radio y bario son metales del grupo de los alcalinotérreos, grupo 2, como puede verse en la tabla periódica. Sin embargo, los elementos descubiertos por Marie en la pechblenda, el radio y el polonio, estaban en los grupos 2 y 16, respectivamente. Ambos están muy alejados en la tabla periódica, lo que indica que tienen propiedades químicas muy diferentes. Además, ambos estaban asociados con el uranio, un elemento de los actínidos que químicamente tampoco tiene relación con ninguno de los dos. Como se descubriría después, la causa de esa extraña asociación no era la afinidad química, sino el proceso de desintegración radiactiva que transformaba unos elementos en otros. La presencia de los tres elementos en el mismo mineral tenía un origen «radiogénico». Marie no solo no tenía esa información entonces, sino que en el caso de haberla intuido ni ella ni ningún otro científico de su época se habrían atrevido a hacerla pública, pues ello habría significado que había tenido lugar el proceso de «transmutación» que habían perseguido infructuosamente durante siglos los alquimistas, por esa época completamente desacreditados.
INDUSTRIA E INVESTIGACIÓN PÚBLICA
Hacia mediados del año 1899 se puso de manifiesto que la extracción de los elementos radiactivos, sobre todo la parte primera de tratamiento de los residuos del mineral, sobrepasaba la capacidad de trabajo de una persona, por lo que Pierre pidió ayuda a la Sociedad Central de Productos Químicos. A partir de entonces este primer tratamiento de los residuos del mineral, que habían llegado de Bohemia por toneladas, se hizo en una de las fábricas de la citada sociedad. En la misma época André Debierne, antiguo alumno de Pierre en la Escuela de Física y Química Industriales y por entonces profesor encargado del laboratorio de química de la Sorbona, comenzó a colaborar con los Curie. Lo primero que hizo Debierne fue adaptar a escala industrial el método de tratamiento para la extracción del radio de los residuos de pechblenda que había diseñado y realizado Marie en el laboratorio; ese fue el comienzo de una larga colaboración con la industria. Tal y como Marie entendía la ciencia, no había una división entre investigación básica y aplicada, sino entre investigación privada y pública. Ella defendía el desarrollo de una investigación de alto nivel financiada por el Estado, que eventualmente podía dar servicio a la industria.
Marie pudo haber patentado el proceso que con tanto trabajo había descubierto de cara a una futura explotación comercial del radio, pero decidió que ella trabajaba para el avance de la ciencia y no para obtener beneficios económicos, por lo que en lugar de patentar el proceso lo hizo público. Es más, tanto ella como Pierre dieron todos los detalles experimentales a quienes se los solicitaron. Muchos años después, durante el viaje que Marie hizo a Estados Unidos pudo ver en los laboratorios que visitó algunas de las cartas que habían enviado con los detalles del proceso.
LA ECUACIÓN MÁS FAMOSA DE LA HISTORIA: E = mc2
Una de las cosas que intrigó a Henri Becquerel desde que descubrió la radiactividad fue el origen de su energía. Por tradición familiar y por su formación termodinámica, Becquerel pensó que se debía tratar de un proceso de fosforescencia de muy larga duración, aunque ninguno de sus experimentos confirmó esta hipótesis. Pierre Curie, que midió el calor emitido por el radio, también pensó en una especie de fosforescencia, en la cual la fuente de energía no era la luz del sol, sino unos rayos cósmicos indetectables, que solo el uranio y el torio eran capaces de atrapar. Aunque todos los experimentos que realizaron apuntaban a ello, ninguno de los dos investigadores fue capaz de imaginar que la fuente de energía venía de dentro del átomo. La clave la dio Einstein en 1906 al poner de manifiesto la equivalencia entre masa y energía. El origen de la energía desprendida en los procesos radiactivos está en unas pequeñísimas cantidades de masa que se «pierden» en las reacciones nucleares, aunque en realidad se transforman en energía, según la ecuación más famosa de la historia, E=mc2, donde E es la energía; m, la masa «perdida» (en realidad, transformada), y c, la velocidad de la luz. Al ser esta velocidad tan elevada (300 000 km/s), aunque la cantidad de masa perdida sea muy pequeña (del orden de la diezmilésima parte de la masa del átomo de hidrógeno), la energía desprendida es muy grande, millones de veces superior a la de cualquier reacción química.
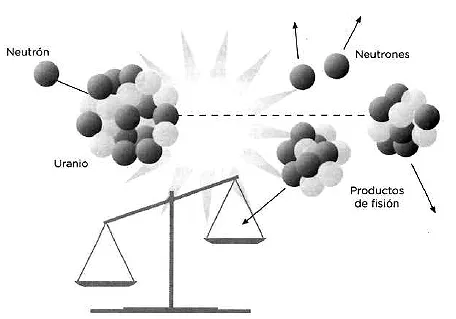
n + 235U → 2,5 n (en promedio) + productos de fisión + 200 MeV
¿POR QUÉ?
En octubre de 1899 el colaborador de los Curie André Debierne anunció el descubrimiento del actinio. Sin duda, los avances realizados en los dos años transcurridos desde que Marie emprendió el estudio de los rayos de Becquerel eran espectaculares. Para empezar, el dispositivo diseñado por Pierre y construido en la Escuela de Física y Química Industriales para la cuantificación del fenómeno de la radiactividad había demostrado su eficacia y precisión. En segundo lugar, se habían identificado los protagonistas de la radiactividad. Por un lado, estaban el uranio y el torio, cuya reactividad y peso atómico eran perfectamente conocidos. Por otra parte, estaban los recién descubiertos polonio, radio y actinio, siendo justamente su radiactividad la prueba más firme de su existencia. Como en aquella época esta prueba no se consideraba suficiente, Marie prosiguió con el laborioso proceso de aislamiento y purificación del radio, tarea que le habría de llevar varios años.
Se habían encontrado muchas respuestas, pero había una cuestión fundamental que seguía sin respuesta: ¿por qué se emitían los rayos? Además, se desconocía su naturaleza y si eran partículas o rayos. Y todavía quedaba otra cuestión aún más difícil de responder ¿de dónde salía la energía que mantenía el proceso activo y aparentemente inalterable en el tiempo? Las hipótesis que consignó Marie en enero de 1899 en una comunicación a la Revue Genérale des Sciences, tal y como las recoge Pierre Radvanyi en su texto dedicado al matrimonio Curie, eran las siguientes:
- 1La radiactividad es una fosforescencia de larga duración producida por la luz. Esta hipótesis es poco probable.
- 2El rayo es una emisión de materia acompañada de una pérdida de peso de las sustancias radiactivas.
- 3La energía utilizable por las sustancias radiactivas disminuye constantemente.
- 4El rayo es una emisión secundaria provocada por rayos análogos a los rayos X. Estos rayos excitantes vendrían del espacio, serían aún más penetrantes que los rayos X y solo serían absorbidos por elementos de gran peso atómico, tales como el uranio y el torio. Es posible suponer que en el espacio tienen lugar transferencias de energía de las que no tenemos noticia.
- 5El rayo se produce a expensas del calor del medio, violando el principio de Carnot.
La hipótesis 1 era la de partida de Becquerel, pero él mismo la descartó a la vista de que las sales de uranio emitían rayos tras haber estado durante períodos prolongados en total oscuridad. La hipótesis 2 estaba en la línea de las primeras especulaciones que hizo Marie en 1897, inmediatamente después de detectar la radiactividad, según las cuales esta era una consecuencia de un cambio profundo a escala subatómica. Es la hipótesis que terminaría demostrándose como acertada. La estrambótica hipótesis 4 es la que le parecía más plausible a Pierre Curie, pero no solo se equivocó él, sino que arrastró a Marie en su error.
Un año y medio después, en el Congreso Internacional de Física que tuvo lugar durante la Exposición Universal de París, celebrada en agosto de 1900, Pierre y Marie, en su presentación de las propiedades de las nuevas sustancias radiactivas, no tuvieron más remedio que admitir su incapacidad para encontrar una explicación plausible de la radiactividad.