Capitulo VII Un año turbulento
La vida seguía y Marie no podía quedarse al margen. Tenía que ocuparse de las clases en la Sorbona y del laboratorio, donde no solo tenía que realizar experimentos, sino también dirigir al resto de sus miembros y buscar financiación para asegurar el futuro del mismo. Y, por supuesto, no podía olvidarse de las niñas. Marie hizo lo que pudo, que fue mucho más de lo que cabría esperar de una persona de extraordinaria decisión y energía. Pero tuvo que enfrentarse a situaciones extraordinariamente difíciles, por encima de las fuerzas de la mayor parte de la gente. Ella consiguió superarlas, pero se llevaron el tiempo, la energía y la salud que habría necesitado para responder a los retos que surgieron en la nueva ciencia que ella había alumbrado.
Poco después de la muerte de Pierre, en agosto de 1906, lord Kelvin, que a sus ochenta y dos años había tomado el barco para cruzar el canal y asistir al entierro de su amigo, hizo unas declaraciones en el periódico The Times poniendo en duda la existencia del radio. Ello ocasionó un terremoto en todos los laboratorios donde se estudiaba la radiactividad, pero sobre todo en el de Marie, que dedicó todas sus energías a obtener una muestra de radio ayudada por André Debierne. En 1910 obtuvieron un sólido blanco brillante mediante electrolisis de una mayor cantidad de RaCl2, siguiendo un procedimiento similar al utilizado por Marckwald y posteriormente por Marie para obtener el polonio.
Tras finalizar este extenuante trabajo y habida cuenta de que Marie era el único científico francés vivo galardonado con el premio Nobel que no era miembro de la Academia de Ciencias, sus colegas le pidieron que presentara su candidatura. Sin embargo, no fue la única candidata al puesto vacante, ya que compitió con Édouard Branly (1844-1940), científico con méritos suficientes para aspirar al puesto.
Ambos científicos tenían puntos a favor y en contra. De este modo, entre los deméritos de Marie estaba que no era «completamente» francesa y que algunos académicos sospechaban que no había hecho contribuciones relevantes por sí misma, sino que en realidad había sido la sombra de su marido. Entre los deméritos de Branly, por su parte, estaba su «traición» a las instituciones públicas francesas, pues había dejado la Sorbona para ocupar una cátedra en el Institut Catholique de París, universidad de carácter privado. Branly representaba así la opción religiosa, y fue apoyado por la parte más conservadora de la Academia. A Marie la apoyaba el sector más progresista y dinámico, que pretendía renovar la vetusta institución, aunque el hecho de que una mujer sin marido se lanzara a reivindicar sus propios méritos molestaba tanto a conservadores como a progresistas.
La notoriedad que el Nobel y la muerte de Pierre habían dado a Marie hizo que la contienda trascendiera los círculos académicos y ocupara las primeras páginas de los periódicos. Y la misma prensa sensacionalista que poco antes se había extasiado con los logros científicos de la joven pareja que trabajaba en condiciones miserables y que había llorado con Marie la muerte de Pierre, fue bastante agresiva con la viuda que pretendía sacar los pies del plato. La elección tuvo lugar en enero de 1911 y Marie perdió por dos votos. Fue un mal comienzo para un año que habría de terminar de forma catastrófica.
Uno de los efectos más negativos del rechazo sufrido por Marie fue que a partir de entonces la investigadora limitó mucho su relación con otros miembros de la Academia. También dejó de publicar en su revista Comptes Rendus de l’Académie des Sciences, el foro en el que los científicos franceses presentaban sus trabajos, los cuales eran publicados de forma bastante ágil.
UN AÑO TURBULENTO
Entre los discípulos de Pierre en la Escuela de Física y Química Industriales, hubo uno particularmente brillante y con una marcada vocación científica, Paul Langevin. Paul ocupó el puesto de Pierre en el centro cuando este obtuvo la cátedra en la Sorbona, y fue compañero de Marie en la École Normale de Sèvres. La relación trascendía los límites profesionales, por lo que se extendió a la esposa de Langevin cuando este se casó, y luego a sus hijos, que formaron parte del selecto grupo de diez alumnos de la «cooperativa» que Marie organizó tras la muerte de Pierre para instruir a sus hijas y a los hijos de sus amigos y colegas científicos. Paul era algo más joven que Marie y cuidaba mucho su apariencia, siendo famoso por su impresionante bigote encerado.
En la primavera de 1910 Marie abandonó los trajes negros que llevaba desde la muerte de Pierre, se adornó con flores y pareció rejuvenecer. Aunque sus amigos se alegraron de que por fin hubiera abandonado el luto, al principio no sabían el motivo. Poco después ella misma lo explicó: su relación con Paul Langevin había trascendido los límites de la pura amistad. Al parecer, ese vuelco estuvo propiciado por la propia esposa de Langevin, que acudió a Marie para quejarse del áspero trato que recibía de su marido. Cuando Marie intentó reconvenirlo, Langevin estalló y le contó cómo en su última discusión, causada por motivos económicos, su esposa le había roto una botella en la cabeza. También le explicó que la vida en su casa era insoportable, con su mujer y su suegra insultándolo y pidiéndole dinero constantemente.
PAUL LANGEVIN, AUSENTE DE LA GALERÍA DEL NOBEL

Paul Langevin (a la derecha) y Albert Einstein (en el centro) en un acto a favor de la paz celebrado en Berlín en 1923.
Paul Langevin (1872-1946) nació en París en el seno de una familia humilde. Pierre Curie fue su profesor en la Escuela de Física y Química Industriales y la persona que habría de tener una mayor influencia en su carrera. Sus otros mentores, Henri Poincaré y Marcel Brioullin, lo definirían como un gran físico teórico particularmente dotado para las matemáticas, que además hizo desarrollos notables en física experimental. Es conocido fundamentalmente por su teoría sobre el diamagnetismo y el paramagnetismo, fenómenos que Pierre Curie había estudiado de modo experimental. Langevin desarrolló su teoría teniendo en cuenta la electrodinámica del movimiento de los electrones, la orientación de sus momentos magnéticos y su movimiento térmico aleatorio. Explicó que el diamagnetismo —la imantación débil en sentido inverso al campo magnético— se debe a efectos de inducción en los circuitos elementales de los electrones en los átomos, mientras que el paramagnetismo —imantación débil a favor del campo magnético— se debe a la orientación de los momentos de espín de los electrones, compensados total o parcialmente por la agitación térmica. Langevin también desarrolló una aplicación de otro de los fenómenos estudiados por Pierre, la piezoelectricidad, para la detección de señales acústicas submarinas, lo que se conoce como sónar. Fue un difusor entusiasta de la teoría de la relatividad y propuso una relación de equivalencia masa-energía similar a la de Einstein, E=mc2, unos meses antes de que este la publicara en 1906. También fue uno de los principales difusores de la teoría cuántica de Planck desde su cátedra en la Sorbona, donde eran famosas sus clases por saber transmitir de forma comprensible y precisa los conceptos más complejos. Nunca rehuyó el compromiso público, y así no dudó en firmar cuando tenía poco más de veinte años el manifiesto de apoyo a Alfred Dreyfus y fue encarcelado por los alemanes cuando tenía casi setenta, por su oposición a la ocupación nazi. Su nieto Michel se casaría con una nieta de Marie Curie, Hélene Joliot-Curie.
Aunque ambos eran de origen modesto, la mujer de Paul no compartía su amor por la ciencia, ni entendía por qué su marido rechazaba trabajos muy bien pagados en la industria para seguir dando clase en la Sorbona y en la École Normale de Sèvres, y luego seguir trabajando horas interminables en el laboratorio, recibiendo por todo ello un sueldo miserable. Marie se quedó anonadada, como antes se había quedado Marguerite Borel, la esposa del matemático Émile Borel que formaba parte del círculo íntimo de ambos y a quien también se lo había contado. Tras un altercado particularmente grave, en el que al parecer no solo había sido agredido por su esposa, sino también por su suegra, Paul alquiló un apartamento cerca del laboratorio, donde Marie comenzó a visitarlo y a hacer planes de una vida en común.
La esposa de Paul, que no contaba con las armas intelectuales de Marie, no se quedó con los brazos cruzados: hizo seguir a su marido, forzar la entrada de su apartamento y robar unas cartas que Marie le había enviado. Este fue el comienzo de una serie de chantajes a Paul y amenazas de muerte a Marie. A petición de Langevin, su amigo el futuro premio Nobel de Física Jean Perrin hizo varias visitas a su mujer para intentar calmarla y propiciar una solución amistosa. Más que por él mismo, Langevin estaba preocupado por las amenazas a Marie, ya que creía que su esposa era capaz de materializarlas. En ese clima de violencia y amenazas, Paul y Marie pasaron el verano de 1911 separados: Paul en Inglaterra, con sus hijos mayores, y Marie y sus hijas en Polonia, donde ella había ido para recuperarse, pues se encontraba enferma.
Nadie del círculo íntimo de Marie y Paul podía imaginar que las trifulcas familiares de Paul culminarían de la forma más cruenta posible para Marie, con la publicación en la prensa de extractos más o menos tergiversados de sus cartas. Así, por ejemplo, en el periódico del 4 de noviembre de 1911 se podía leer que «el fuego del radio que arde tan misteriosamente ha encendido una llama en el corazón de un científico, y su esposa e hijos están ahora llorando…». Según la prensa, lloraban porque el «Chopin de la Polonesa», como denominaban a Langevin, había huido con su amante al extranjero. Efectivamente, ambos estaban en el extranjero y en la misma ciudad, pero ni habían ido, ni estaban juntos. Ambos asistían al congreso Solvay celebrado en Bruselas, que reunió a la más brillante constelación de científicos de todas las épocas, entre los que se contaban Einstein, Planck, Wien, Poincaré, Rutherford y De Broglie, entre otros.
Cuando Marie volvió a París le esperaba lo peor. Espoleada de la forma más rastrera por la prensa sensacionalista, una muchedumbre enfurecida rodeaba su casa. Tiraban piedras a las ventanas, llegando a romper algunos cristales, mientras a ella la llamaban ramera y le decían a gritos que volviera a su país. Los insultos se sucedían: judía, ladrona de maridos, extranjera, dreyfusard… Los ecos del affaire Dreyfus, en el que un oficial de origen judío-alsaciano del ejército francés había sido acusado falsamente de traición, no se habían apagado. La clase francesa más reaccionaria no había digerido su derrota y se vengó en Marie.
La integridad física de Marie y sus hijas peligraba, por lo que tuvieron que refugiarse en casa de los Borel, que vivían en un edifico anejo a la École Normale, de la cual Émile Borel acababa de ser nombrado director. Hasta allí no llegó el rugido de la muchedumbre, pero sí el del ministro de Instrucción Pública, que le pidió a Borel que no diera asilo a esa mujer, que la convenciera de que lo mejor que podía hacer era volver a su país, amenazándolo con destituirlo si no lo hacía. Según algunas versiones, Borel se negó tajantemente; según otras, Marguerite, su esposa, le dijo que, si se iba Marie, también se iría ella.
Entre los apoyos más fervientes que recibió Marie en esos días hay que destacar el de su cuñado Jacques Curie, que nada más enterarse del escándalo le escribió una carta dándole todo su apoyo y mostrando su indignación por el ataque del que estaba siendo objeto. No contento con eso, escribió a los periódicos que tan cruelmente habían atacado a la investigadora, dando fe de la absoluta devoción de Marie por su hermano, del cariño de su padre y de la felicidad de ambos mientras vivieron con ella. El apoyo de Jacques era incondicional; no dependía de la veracidad de las cartas publicadas por la prensa.
Las acusaciones de los diarios siguieron subiendo de tono y Gustave Téry, editor de un periódico sensacionalista, xenófobo y antisemita, llegó a insinuar que la muerte de Pierre podía no haber sido un accidente. Según Téry pudo haber sido un suicidio al tener conocimiento Pierre de una relación que habría empezado antes de su muerte. O incluso algo peor. Langevin se vio obligado a retarlo a duelo. Este terminó sin heridos, pues Téry finalmente no disparó para «no privar a unos hijos de su padre y a Francia de un cerebro precioso», como explicó él mismo en su periódico al día siguiente.


FOTO SUPERIOR IZQUIERDA: Marie en una fotografía realizada tras la muerte de Pierre.
FOTO SUPERIOR DERECHA: Paul Langevin y Marie junto a un grupo de alumnas y colaboradoras en una fotografía tomada en 1910.
FOTO INFERIOR: Marie y el selecto grupo de científicos que asistieron al congreso Solvay de 1911 (Einstein, por ejemplo, es el segundo de la derecha).
Por otro lado, la intervención de los amigos y compañeros de Marie hizo cambiar de opinión al ministro, pero entonces se abrió un nuevo frente. El 8 de noviembre de 1911, en el punto álgido del escándalo Langevin, Marie recibió un telegrama de Estocolmo comunicándole que le habían concedido el premio Nobel de Química. Ella dudaba de la conveniencia de ir a recogerlo, dadas las circunstancias por las que estaba atravesando, pero Svante Arrhenius, miembro de la Academia sueca y premio Nobel de Química en 1903, intentó animarla para que acudiera a recibir el galardón. Le dijo que nada de lo que se hubiera publicado en la prensa francesa iba a tener eco en el acto de entrega. No obstante, el 1 de diciembre le escribió una nueva carta diciéndole que la evolución de los acontecimientos le había hecho cambiar de opinión y que lo más conveniente era que Marie se abstuviera de viajar a Estocolmo hasta que no se demostrara la falsedad de los documentos publicados. De nuevo el académico Gösta Mittag-Leffler, que ya había tenido un papel determinante en la concesión del primer premio Nobel a Marie, le escribió diciéndole que si se ausentaba daría pábulo a las habladurías. Entonces Marie, sin vacilaciones ya, contestó a Arrhenius el 5 de diciembre:
La postura que me recomienda me parece un error grave por mi parte. En efecto, el premio me ha sido concedido por el descubrimiento del radio y del polonio. Opino que no hay ninguna relación entre mi trabajo científico y los hechos de mi vida privada que se pretenden invocar contra mí en las publicaciones de baja estofa, que están por otro lado completamente desnaturalizadas. Por principio no puedo aceptar que la apreciación del mérito de un trabajo científico pueda verse influenciada por las difamaciones y calumnias en relación con la vida privada. Estoy convencida de que esta opinión será compartida por muchas personas. Siento mucho que usted no piense lo mismo.
El 11 de diciembre Marie, acompañada de su hija Irène, que entonces tenía catorce años, fue a Estocolmo a recoger el premio, y al día siguiente impartió la conferencia de recepción. En ella homenajeó a Pierre, pero puso de manifiesto sus propias contribuciones al descubrimiento y aislamiento de los dos elementos por los cuales le habían concedido el premio. Hizo una mención muy especial a los trabajos de Rutherford, y reconoció la brillantez de la teoría de la desintegración atómica que aquel formuló junto con Soddy.
De forma premonitoria dijo que con la radiactividad había surgido una nueva química que no estaba basada en el uso de la balanza, sino en el del electrómetro. Hasta entonces, la propiedad característica que identificaba un elemento químico había sido su peso atómico, de ahí los largos años de trabajo que dedicó Marie a determinar el peso atómico del radio. El modelo del átomo nuclear que acababa de proponer Rutherford, y el descubrimiento subsiguiente de los «isótopos», demostraría lo incorrecto de esa definición. Los químicos seguirían usando balanzas, pero el peso atómico, que pasó a denominarse masa atómica, ya solo sería una propiedad más de los elementos químicos, no la que los identificaba de forma inequívoca.
Cuando volvió a Francia, Marie se hundió. A pesar de sufrir una profunda depresión intentó seguir trabajando, pero tuvo una grave infección de riñón y otras complicaciones que la mantuvieron alejada del laboratorio durante un año. Parte de este tiempo estuvo ingresada en hospitales; otra parte estuvo desaparecida, escondida en Inglaterra con su nombre de soltera, en casa de su amiga Hertha Ayrton, viuda reciente de un profesor de Física, y física ella misma. Los Curie habían conocido a los Ayrton durante el viaje a Inglaterra que realizaron en 1903, poco antes de la lectura de la tesis de Marie, y desde entonces habían cultivado una amistad que en esta época extraordinariamente difícil resultó preciosa para Marie.
La relación con Langevin continuó hasta la muerte de Marie, pero no como ella había imaginado. Mantuvieron tanto la colaboración científica como la amistad, pero la pasión que había devuelto la sonrisa a Marie murió en el duelo entre Téry y Paul. Al parecer, Langevin se reconcilió con su esposa algún tiempo después, lo que finalmente no le impidió desarrollar una carrera científica brillantísima, la cual, curiosamente, nunca fue premiada con el Nobel. En Inglaterra, Marie encontraría finalmente la paz y renacería una vez más de sus cenizas.
RUTHERFORD Y EL DESCUBRIMIENTO DEL NÚCLEO ATÓMICO
¿Qué había sido mientras tanto del que en su juventud era un buen jugador de rugby y más tarde intuyó antes que nadie que el átomo podía desintegrarse? Ernest Rutherford terminó su «exilio» americano en enero de 1907, poco después de la muerte de Pierre. Aunque había recibido generosas ofertas de prestigiosas universidades americanas, como Yale y Stanford, él quería volver a la vieja Europa, que todavía era el centro del mundo en ciencia. La oportunidad se presentó cuando la Universidad de Manchester le ofreció la cátedra de Física; según se decía, Manchester tenía el mejor departamento de Física de Gran Bretaña, después del Cavendish de Cambridge, por supuesto.
EL EXPERIMENTO DE GEIGER Y MARSDEN
A instancias de Rutherford. Hans Geiger y Ernest Marsden realizaron en 1909 un experimento en el cual bombardearon una finísima lámina de oro de una micra de espesor (1 milésima de mm, lo que en joyería se llama «pan de oro») con partículas α procedentes de una fuente radiactiva. Los científicos observaron que la mayor parte de las partículas atravesaban la lámina sin sufrir apenas desviaciones; unas cuantas sufrían pequeñísimas desviaciones (más del 99 % se desviaban ángulos inferiores a 3°), y, sorprendentemente, una de cada 10 000 era dispersada con un ángulo superior a 90° (es decir, «rebotaba»). Esta última observación era totalmente inexplicable con el modelo atómico de Thompson. A partir de estos resultados, Rutherford propuso su modelo planetario del átomo, en el cual el átomo estaba prácticamente «vacío», siendo esa la causa de que la mayor parte de las partículas α no desviaran su trayectoria al atravesar la lámina de oro. Rebotaban las que se encontraban en su camino en una zona muy densa de carga positiva, que Rutherford definió como el «núcleo» atómico. En el núcleo se concentraba casi toda la masa del átomo y su radio era 10 000 veces menor que el de todo el átomo. En la corteza del átomo, los electrones —partículas de carga negativa con una masa miles de veces menor que la del núcleo— orbitaban en torno a él, como los planetas alrededor del sol. Este modelo planteaba un nuevo problema, porque, según la física clásica, los electrones deberían perder energía en su trayectoria circular, por lo que al tener carga opuesta y ser atraídos por el núcleo deberían terminar por caer en él. Este problema lo solucionaría poco después otro alumno de Rutherford, Niels Bohr.
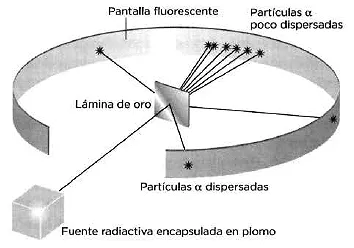
Esquema del dispositivo experimental de Geiger y Marsden.
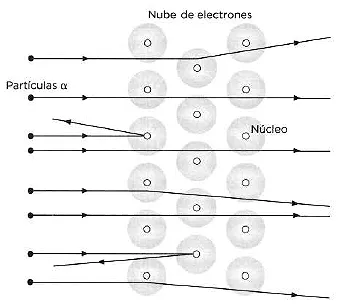
Trayectorias de las partículas α en el modelo planetario de Rutherford.
Un año después de llegar a Manchester, Rutherford recibió el premio Nobel, junto con Soddy, por el descubrimiento de los procesos de desintegración radiactiva. Esta concesión, más que alegrarlo, consiguió enervarlo, pues se lo concedieron en la categoría de Química, y él solía decir que la ciencia o era física o era coleccionismo de sellos. Muchos años después le gustaba seguir burlándose de la preferencia de muchos químicos por la experimentación frente al pensamiento abstracto, al parecer terreno exclusivo de los físicos. Así, en una charla informal que impartió hacia 1930 en el Alembic Club de los estudiantes de Química de la Universidad de Oxford, dijo: «Si ustedes los químicos trabajaran menos y pensaran más, ¡qué avances tan portentosos podríamos ver en su ciencia en los próximos años!».
El premio Nobel no representó para Rutherford ninguna meta, si acaso fue todo lo contrario, el pistoletazo de salida para que su creatividad realizara la carrera más deslumbrante. Una vez instalado en Manchester, con la ayuda del más brillante grupo de discípulos que un profesor haya tenido jamás, transformaron para siempre nuestra percepción de la materia.
A comienzos del siglo XIX John Dalton —que también había trabajado en Manchester, donde fue profesor de Matemáticas y de la entonces llamada «Filosofía de la Naturaleza»— retomó el concepto de átomo propuesto por Demócrito en el siglo V antes de nuestra era, y lo definió como la parte más pequeña de materia que conservaba sus propiedades. En su modelo, los átomos eran esferas sólidas, rígidas e indivisibles. Los descubrimientos de finales del siglo XIX de la naturaleza eléctrica de la materia pusieron de manifiesto la existencia de partículas subatómicas portadoras de carga. Tras identificar la relación carga/masa de los electrones, J. J. Thomson propuso su modelo de pastel de pasas, en el cual casi toda la masa y toda la carga positiva del átomo estaban distribuidas de forma uniforme, mientras que las cargas negativas estaban embebidas en dicha masa, como las pasas en el pastel. Este era el modelo en vigor cuando Rutherford puso de manifiesto la naturaleza de las desintegraciones radiactivas. Las partículas α usadas diestramente como proyectiles por sus discípulos Geiger y Marsden habrían de demostrar lo erróneo del mismo. Como contaba Rutherford en una conferencia que dio en Cambridge muchos años después, en 1936:
No creía que las partículas α pudieran ser dispersadas a ángulos altos, porque sabíamos que eran pesadas y tenían mucha energía. […] Recuerdo que dos o tres días después Geiger llegó muy excitado diciendo «hemos detectado algunas partículas α retrodispersadas». Era el hecho más increíble que me había ocurrido en la vida. Tan increíble como si al disparar una bala de cañón de 15 pulgadas contra una hoja de papel, la bala rebotara. Me di cuenta de que esta retrodispersión debía ser el resultado de una colisión única, y cuando hice los cálculos vi que era imposible tener algo de este orden de magnitud a menos que tuviera un sistema en el cual la mayor parte de la masa del átomo estuviera concentrada en un núcleo minúsculo. Fue entonces cuando tuve la idea de un átomo con un centro masivo, diminuto y portador de carga.
La distribución de carga y masa del átomo que imaginó Rutherford en 1911 es muy parecida a la que conocemos hoy. El átomo está prácticamente vacío, y en él la carga positiva y la mayor parte de la masa se concentran en un núcleo diminuto que ocupa su centro, mientras que los electrones orbitan a su alrededor formando una especie de nube. Este núcleo tendría el tamaño de una perla si el átomo completo, cuyo tamaño viene definido por las nubes electrónicas, tuviera el tamaño de un estadio de fútbol. Todas las reacciones químicas no son más que modificaciones de la distribución de los electrones más alejados del núcleo, algo así como los movimientos de los espectadores de las gradas altas del estadio. Pero como sucede en un partido en el cual todo el público está pendiente de lo que sucede en el centro del campo por muy arriba que esté su asiento, en el átomo, los más pequeños vaivenes de los electrones de la corteza vienen determinados por su interacción con la carga positiva del núcleo.
EL CONTADOR GEIGER
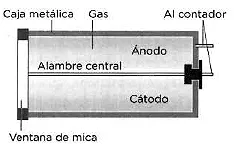
Esquema de un contador Geiger.
Cuando se piensa en entornos contaminados por radiactividad, es muy probable pensar también en un ruido especial, una especie de tableteo. Es la señal acústica que lleva asociada el contador Geiger cuando detecta las partículas α o β producidas en las reacciones nucleares. Este contador es el dispositivo que usó Marie Curie cuando su hija Irène le llevó el aluminio radiactivo, primer producto de la radiactividad artificial. El aparato original fue diseñado por Rutherford y Geiger, uno de sus colaboradores en Manchester, en 1908. Rutherford usaba las partículas α como proyectiles para identificar la naturaleza de los procesos radiactivos. Para cuantificarlas, alguien tenía que contar el número de destellos que las partículas α producían en una pantalla fluorescente de sulfuro de cinc. El mejor en esa tarea era Hans Geiger, que podía contarlas durante horas sin cometer ni un solo error. El físico alemán ideó entonces un dispositivo que lo librara de esa tediosa tarea y así surgió el primer prototipo del contador Geiger, que luego perfeccionaría con su discípulo Müller. El aparato consta de un tubo de metal, que funciona como cátodo, relleno con un gas inerte, como el argón: dentro tiene un alambre que funciona como ánodo. El tubo debe tener una ventana formada por una lámina muy fina que permita el paso de la radiación, pero que impida que se salga el gas, que suele ser de mica o PET. Cuando la radiación ionizante (partículas α o β) incide sobre un átomo de argón, le arranca un electrón que por su carga negativa es atraído por el ánodo, mientras que el catión Ar+ producido es atraído por el cátodo. Como consecuencia del proceso se genera una pequeña corriente en el contador, proporcional a la intensidad de la radiación. La corriente producida por la radiación que causa la ionización de un gas es el mismo proceso que medía Marie con su balanza de cuarzo, pero la forma de cuantificarlo es mucho más simple.
Las inconsistencias del modelo atómico planetario de Rutherford, en el cual los electrones orbitaban alrededor del núcleo como los planetas giran alrededor del Sol, fueron solucionadas por uno de sus discípulos, Niels Bohr. Este físico danés, adoptando la hipótesis cuántica de Planck, postuló en 1913 que los electrones eran estables en sus órbitas y no emitían energía, en contra de lo predicho por la física clásica para una partícula cargada en movimiento circular. Los postulados de Bohr no solo hacían viable el modelo planetario de Rutherford, sino que explicaban otros muchos resultados previos, especialmente los espectros atómicos. Los trabajos de Schrödinger y Heisenberg a finales de la década de 1920 terminaron de dibujar el modelo cuántico del átomo. Junto a este importante desarrollo teórico, en el laboratorio de Manchester tuvo lugar un desarrollo experimental aparentemente menor pero que resultó de gran trascendencia: Geiger diseñó un dispositivo que permitía contar las partículas α una a una. Su contador se convirtió en la herramienta imprescindible en todos los laboratorios en los que se estudiaba y se estudia la radiactividad.
Paralelamente se desentrañó otro de los misterios de la radiactividad. En el estudio de los elementos producidos en las series de desintegración radiactivas, Soddy había observado en 1910 que las especies que él denominó «mesotorio» y «torio-X», así como el radio, eran imposibles de separar, por lo que empezó a pensar en la posibilidad de que más de una especie ocupara el mismo lugar en la tabla periódica. En 1913 se confirmó su intuición cuando el alemán Kazimierz Fajans —que también había trabajado en Manchester con Rutherford— llegó a las mismas conclusiones. Las denominadas «leyes de Soddy-Fajans de desintegración radiactiva» establecían que cuando un elemento emitía una partícula α se desplazaba dos posiciones a la izquierda en la tabla periódica, y cuando emitía una partícula β se desplazaba una posición a la derecha.
Soddy comprobó que, si un elemento emitía una partícula α y a continuación dos β, no se obtenía el elemento de partida, sino otra sustancia con sus mismas propiedades químicas, pero con diferente tiempo de semidesintegración. Discutiendo esta aparente incongruencia en una cena familiar, la doctora escocesa Margaret Todd propuso a Soddy el término «isótopo» para nombrar a las sustancias que compartían sitio en la tabla periódica. El primer indicio de la existencia de isótopos lo proporcionó J. J. Thomson al encontrar dos líneas atribuibles al neón en los rayos canales (los anódicos o positivos).
LEYES DE SODDY-FAJANS DE DESINTEGRACIÓN RADIACTIVA
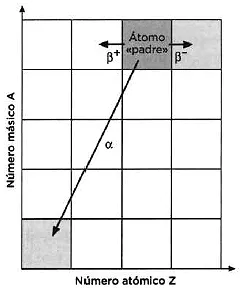
Estas tres leyes fueron propuestas por Frederick Soddy y Kazimierz Fajans de manera independiente en 1913.
- 1
- 2
- 3
Hoy en día se sabe que la partícula α es el núcleo del átomo de helio (por lo tanto, su símbolo es ), mientras que las partículas β− y β+ son electrones y positrones respectivamente.
La prueba definitiva la proporcionó su discípulo Francis William Aston tras volver del frente una vez finalizada la Primera Guerra Mundial. Empleando la espectroscopia de masas que había descubierto Thomson, Aston separó dos especies del gas neón de masa 20 y 22 y propuso su «regla del número entero», según la cual los elementos cuyo peso atómico no era entero tenían varios isótopos en proporciones no despreciables. Ese resultó ser el caso del neón, cuyo peso atómico 20,2 era el promedio del peso atómico del neón-20, cuya abundancia relativa es 90,5 %, y del neón-22, cuya abundancia es 9,5 %. Un caso similar es el del cloro, cuyo peso atómico 35,45 es el correspondiente al promedio del peso del isótopo cloro-35 (76 %) y cloro-37 (24 %). Aston obtuvo por sus investigaciones el premio Nobel de Química en 1922. El peso atómico dejó de ser la propiedad característica de un elemento químico, confirmando el nacimiento de la «química de lo imponderable» a la que se refirió Marie.
Henry Moseley, otro colaborador de Rutherford en Manchester, encontró la propiedad característica de cada elemento. Midió los espectros de emisión de rayos X de todos los elementos conocidos entonces, y encontró que la raíz cuadrada de la frecuencia de los rayos X emitidos era proporcional a una cantidad única para cada elemento. Moseley identificó esa cantidad como la carga del núcleo central positivo y la llamó Z, lo que hoy se conoce como número atómico. Publicó sus resultados en dos artículos que envió poco antes de partir al frente y que aparecieron en 1913 y 1914. Nunca sabría que justo el año en que murió en la guerra, 1915, había sido uno de los candidatos más jóvenes al Nobel.
Moseley observó que Z aumentaba en el mismo orden que el peso atómico, excepto en el caso de los elementos cobalto, níquel, yodo y teluro. ¿A qué podían deberse esas excepciones? Obviamente a la existencia de isótopos más pesados en los elementos de menor número atómico. Pero ¿por qué existían los isótopos? Porque en el núcleo había otra partícula además de protones, que había escapado a toda detección al no tener carga: el neutrón. Rutherford ya anticipó su existencia en 1920, pero hasta 1932 no la confirmó experimentalmente otro de sus alumnos, James Chadwick. Lo hizo repitiendo un experimento llevado a cabo en el Instituto del Radio por Irène Curie y su esposo Frédéric Joliot-Curie. Consistía en bombardear una lámina de berilio con partículas α, lo que provocó una emisión de unos rayos que ellos interpretaron como y de alta energía, los cuales producían protones a su paso por una parafina. Rutherford no dio crédito a estos resultados; Chadwick sí, pero no a su interpretación. Sabiendo lo que tenía que buscar y usando el detector apropiado encontró el neutrón, obteniendo por ello el premio Nobel de Física en 1935. Con su descubrimiento, Chadwick terminó de completar el rompecabezas de la estructura del átomo.
EL LEGADO DE MOSELEY
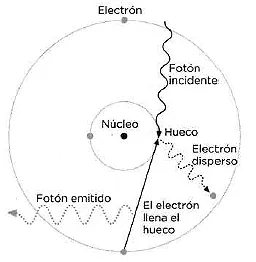
Tras conocer los fenómenos de difracción que habían puesto de manifiesto Von Laue y Bragg, Henry Moseley (1887-1915) fue al laboratorio de este último en la Universidad de Leeds, porque quería saber más sobre la interacción de los rayos X con la materia. Tras familiarizarse con la producción de rayos X, investigó la energía de los rayos emitidos empleando como ánodos los 73 elementos químicos conocidos hasta entonces. Encontró una relación lineal entre la longitud de onda de los rayos emitidos por cada elemento y una magnitud característica que Moseley identificó como la carga nuclear. A partir de sus valores realizó una nueva ordenación de los elementos en la tabla periódica, corrigiendo la que había hecho Mendeléyev a partir de los valores del peso atómico y prediciendo la existencia de otros aún por descubrir. El proceso que tenía lugar en los experimentos que realizó Moseley se resume en la figura adjunta, que muestra un esquema del átomo según el modelo de Bohr, basado a su vez en el de Rutherford: un fotón incidente (línea ondulada superior) arranca un electrón (línea ondulada derecha) de las capas internas de la corteza electrónica. El hueco es rellenado por un electrón de las capas superiores que emite a su vez otro fotón con la diferencia de energía (línea ondulada izquierda) entre los dos niveles implicados. Cada elemento químico emite un fotón con una energía característica, proporcional al número de protones del núcleo. La energía de los fotones da lugar a las líneas de fluorescencia de rayos X que sirvieron a Moseley para definir el número atómico, Z. Este proceso es la base de uno de los métodos de análisis químico no destructivo más sensible, la fluorescencia de rayos X. Moseley realizó la primera parte de su investigación en los laboratorios de Rutherford, en Manchester, y la última en el laboratorio Clarendon de Oxford, donde no tenía ni conexión a la red eléctrica, costeándoselo todo él mismo. Oficialmente, dejó Manchester para volver con su madre a Oxford, pero sobre todo quería salir de la sombra del Profesor y de la pléyade de sus brillantísimos alumnos, que podían ensombrecer su propio trabajo.
EL INSTITUTO CURIE
El trabajo de Marie había atraído la atención de patrocinadores generosos, particularmente los millonarios norteamericanos Carnegie y Rothschild, que tuvieron conocimiento de sus investigaciones cuando murió Pierre. Con sus aportaciones se estableció un programa de becas para trabajar en el laboratorio de Marie, si bien estos programas no recibían ningún apoyo por parte de las instituciones francesas.
Por otro lado, tras la muerte de Pierre, había surgido la idea de crear un laboratorio bien dotado para estudiar la radiactividad, que además sirviera para preservar su memoria. La idea se materializó cuando a finales de 1909 el doctor Émile Raoux, director del Instituto Pasteur y ferviente admirador de Marie, propuso crear el Instituto del Radio. Cuando este organismo privado lanzó la iniciativa, la Universidad de la Sorbona se unió a ella proporcionando los terrenos y parte de la financiación para la construcción del edificio. Constaría de dos pabellones, uno dedicado a realizar estudios biológicos y de tratamientos del cáncer, que se llamaría Pabellón Pasteur, y otro dedicado a la investigación de los aspectos físicos y químicos de la radiactividad, que se llamaría Pabellón Curie.
Tras su vuelta a París a finales de 1912, una vez decidida a olvidar el escándalo Langevin, Marie se dedicó a supervisar las obras y la instrumentación del Pabellón Curie. La construcción finalizó en julio de 1914, siendo Marie nombrada directora del Pabellón Curie, y el doctor Claudius Regaud, director del Pabellón Pasteur. Marie se encargó personalmente de diseñar y plantar los árboles y los rosales del jardín que unía los dos edificios, pues quería no solo un laboratorio bien dotado, sino un sitio hermoso donde trabajar. Parecía que el sueño de Marie se había cumplido, pero una vez más sus planes se torcieron. En Europa soplaban vientos de guerra y el 1 de agosto Francia anunció la movilización. Todos los hombres del laboratorio se fueron a defender a su país. El 2 de septiembre cayeron tres bombas en París y Marie decidió que ella no podía quedarse al margen.
Como el ejército alemán se aproximaba a París, Marie se ocupó de poner a salvo el preciado radio: lo colocó en una pesada caja de plomo y lo llevó en tren a Burdeos. Tras depositar su tesoro en la caja fuerte de un banco, Marie volvió a París, siendo la única mujer en un tren atestado de soldados. Ningún civil hacía ya el viaje en ese sentido, pero ella sentía que su sitio estaba en la capital.
«Estoy decidida a poner todas mis fuerzas al servicio de mi país de adopción, ya que ahora no puedo hacer nada por mi desafortunado país natal».
—CARTA DE MARIE A PAUL LANGEVIN, ENERO DE 1915.
LAS «PETITES CURIES»
Pronto encontró Marie la mejor forma de servir a Francia. Por sus clases en la Sorbona estaba familiarizada con la producción de los rayos X y también con su uso en medicina, formación que completó su amigo el doctor Antoine Béclère con un curso práctico de manejo de aparatos radiológicos en los servicios hospitalarios. Por este médico supo de la carencia de sistemas radiológicos en el frente, lugar donde eran particularmente útiles para curar huesos fracturados y localizar balas y piezas de metralla en los cuerpos de los soldados heridos. Marie decidió intervenir. El hecho de no contar con instrumentación, personal especializado, fondos y, sobre todo, interés por parte de los médicos militares, no la arredró.
De entrada, decidió que era necesario instalar equipos fijos en los hospitales de campaña y formar personal para que los manejara. Pero pronto vio que la ayuda en la retaguardia llegaba demasiado tarde para muchos soldados, por lo que decidió que era imprescindible contar con equipos móviles que recorrieran los frentes. Ahí se encontró con la oposición frontal del ejército: era demasiado peligroso que personal civil recorriera los campos de batalla, y además era un engorro que podía entorpecer las maniobras militares. Pero Marie fue inflexible: sería criminal dejar que los soldados murieran o quedaran incapacitados por no prestarles un servicio que ella podía ofrecer. Removió cielo y tierra, tanto en el Gobierno como entre las altas jerarquías militares, y su presencia en los frentes fue finalmente autorizada. Entonces requirió la ayuda de fabricantes de automóviles, de empresarios y de personas adineradas con automóvil propio para que los donaran al recién creado servicio de radiología. Para no depender de chóferes y mecánicos, ella misma aprendió a conducir y a arreglar las averías más frecuentes. Para equipar las unidades móviles empleó las fuentes de rayos X fabricadas en España por un industrial de Ciudad Real formado en Estados Unidos durante el boom de la electricidad, Mónico Sánchez. Las primeras unidades móviles estaban dispuestas a finales de octubre de 1914.
Marie contó con una colaboradora de excepción. Su hija Irène, que entonces solo tenía diecisiete años, se negó a estar en un pueblo de la costa con los «niños». Quería ser útil, pero sobre todo no soportaba estar lejos de su madre. Si Marie contó con el amor incondicional de mucha gente, no hay duda de que dos de las personas que la quisieron más apasionadamente fueron sus hijas. Marie e Irène realizaron cursos de enfermería, anatomía y radiología que las habilitaron para trabajar en los servicios de radiología de los hospitales militares. Ambas realizaron su primer viaje el 1 de noviembre a bordo de las unidades móviles que pronto fueron bautizadas como petites Curies. Aunque al principio no resultó fácil que los médicos militares se dejaran aconsejar por personal civil, que además eran mujeres que carecían de formación médica oficial, una vez superadas las reticencias iniciales, las ventajas de las radiografías fueron tan evidentes que su uso acabó por imponerse. Fumes, Joinville, Poperinge, Amiens, Reims, Verdún… Ningún frente les fue ajeno. Marie sintió el inmenso dolor de ver miles de vidas segadas en plena juventud, pero tuvo la alegría de salvar muchas otras. Aunque le horrorizaba la guerra, para ella no todos los ejércitos eran iguales. Haber pasado la infancia y la juventud en un país sojuzgado la convencieron de que no se podía obtener la paz a cualquier precio.
El incremento de la demanda puso de manifiesto la necesidad de contar con personal especializado adicional, que tenía que ser femenino, pues todos los hombres adultos estaban movilizados. El lugar para formarlo fue el Instituto Curie, que se estrenó en una función para la que no había sido diseñado. A comienzos de 1916 comenzaron los cursos de formación de asistentes radiológicas, los cuales fueron impartidos por Marie. Fueron seguidos por unas 150 mujeres provenientes de todas las clases sociales, algunas de las cuales eran enfermeras, si bien la mayoría no tenía formación previa. Al final de la guerra estaban operativos más de 200 puestos fijos en servicios radiológicos en los hospitales de campaña y 20 petites Curies. Solo durante los años 1917 y 1918 se registraron en ellos 1 100 000 radiografías que salvaron incontables vidas y ahorraron mucho sufrimiento.
Otro de los servicios médicos que Marie atendió durante la guerra fue el de radioterapia. Con la única ayuda de una pequeña bomba de vacío, Marie rellenó multitud de ampollas con la emanación desprendida del radio, que fueron distribuidas por los hospitales franceses para abastecer los servicios de radioterapia. Tampoco este trabajo debió de ser muy saludable.


FOTO SUPERIOR IZQUIERDA: Marie y su hija Irène en el Instituto del Radio.
FOTO SUPERIOR DERECHA: El presidente de Estados Unidos Warren G. Harding y Marie durante la recepción celebrada en la Casa Blanca en 1921.
FOTO INFERIOR IZQUIERDA: Inauguración del Instituto del Radio; de izquierda a derecha, Claudius Regaud, Marie y Jean Perrin.
FOTO INFERIOR DERECHA: Marie al volante de una «petite Curie».
La guerra dejó a Europa arrasada, pero el armisticio trajo una noticia con la que Marie había soñado desde antes de nacer: Polonia volvía a ser un país independiente. Los muertos se contaban por millones, pero hubo al menos dos víctimas que no figuraron en ninguna estadística. Marie y su hija Irène, que entonces no era más que una adolescente, se vieron expuestas a grandes dosis de irradiación con rayos X, por lo que luego pagarían un alto precio, sobre todo, Irène. Pero ella al menos obtuvo un reconocimiento oficial por parte del Estado francés. Sin embargo, su madre, que había diseñado y puesto en marcha el servicio, que había donado al Estado sus medallas, incluidas las de los premios Nobel, y que había comprado bonos de guerra con el importe de los mismos, solo tuvo la satisfacción del deber cumplido. A pesar de los años transcurridos y de los servicios prestados durante la guerra, Marie no obtuvo ningún reconocimiento oficial por parte de los estamentos públicos franceses, que aún no le perdonaban que hubiera «manchado» el nombre de su marido.
EL VIAJE A ESTADOS UNIDOS
Marie era una celebridad mundial y, tras finalizar la guerra, muchos periodistas llamaron a su puerta. Pero, dada la terrible experiencia con la prensa durante el escándalo Langevin, Marie no atendía a ninguno. Una americana particularmente insistente, Marie Meloney, fue a París y decidió que no se movería de allí hasta que no consiguiera entrevistarla. Cuando por fin se encontraron, se estableció una comunicación especial entre ellas, que solo se interrumpiría con la muerte de la investigadora. Meloney quedó impresionada por la timidez y modestia de Marie y por las austeras condiciones en las que trabajaba. A Marie, por su parte, la sedujo la fuerza y determinación de la periodista.
Meloney le propuso un plan para recaudar los 100 000 francos que hacían falta para comprar el gramo de radio que Marie necesitaba para su laboratorio. Se haría una colecta entre las mujeres norteamericanas que culminaría con el viaje de Marie a Estados Unidos para recoger el preciado elemento. Con el consentimiento de Marie y con el fin de conseguir su objetivo, Meloney puso en marcha un fabuloso aparato propagandístico. Trabajó incansablemente, persuadió, distorsionó y exageró todo lo necesario hasta conseguir difundir el mito «Madame Curie» en Estados Unidos. Obviamente, el asunto Langevin quedó borrado.
Marie Curie y sus hijas hicieron el viaje en mayo de 1921, que tuvo su final apoteósico en la recogida del botín, un gramo de radio encapsulado en plomo y este a su vez guardado en un cofre de madera, en la Casa Blanca de manos del presidente Warren G. Harding. Sin embargo, Marie se encontraba muy débil y no estaba preparada para los baños de multitudes enfervorizadas que la esperaban. Al llegar al puerto de Nueva York un admirador le dio un apretón de manos tan caluroso, que casi le parte la muñeca, por lo que estuvo gran parte del viaje con ella vendada. A pesar de que la debilidad de Marie era manifiesta, finalmente consiguió sobrevivir al maratoniano programa de visitas a colegios, universidades, sociedades y laboratorios que le había preparado Meloney, aunque en muchos de los actos la reemplazaron sus hijas. También tuvo ocasión de disfrutar con la visita a varios parques naturales, especialmente el del Gran Cañón del Colorado, que recorrió montada en burro, junto con sus hijas.
En 1929 repitió un viaje similar, también organizado por Meloney, aunque con un programa mucho menos denso. El objetivo era recaudar los fondos necesarios para comprar otro gramo de radio para el Instituto Marie Skłodowska-Curie, que había fundado su hermana Bronia en Varsovia, del cual ella era presidenta honorífica. El presidente que le entregó el radio esta vez fue Herbert Hoover, que la invitó a quedarse en la Casa Blanca varios días. Poco después de que tomaran el barco para realizar el viaje de vuelta, la bolsa de Nueva York se desplomó marcando el comienzo de la Gran Depresión.
EL FIN Y LA CONTINUACIÓN
La salud de Marie, que no su determinación, se había deteriorado mucho, sufriendo frecuentemente de anemia y habiendo desarrollado cataratas precoces, ambas enfermedades consecuencia directa de su exposición a la radiación. Las cataratas la habían dejado ciega, pero tuvo que sufrir hasta cuatro operaciones para librarse de ellas. A veces hablaba de retirarse a cuidar el jardín, pero el laboratorio era su vida. Al frente del mismo estaba ya su hija Irène, que desde el final de la guerra se había convertido en su colaboradora más eficaz. Frédéric Joliot, un joven atildado y con un extraordinario don de gentes, que había entrado a trabajar como asistente de Marie por recomendación de Paul Langevin, se convertiría en el compañero de Irène en el trabajo y en la vida. Ella había obtenido el grado de doctora en Física por el estudio de la radiactividad del polonio, el escurridizo elemento que su madre había descubierto. Él lo obtuvo por los resultados en la investigación de la reactividad química de este elemento. Irene y Frédéric descubrieron, pero no identificaron inequívocamente, un isótopo radiactivo del lantano. Más tarde analizarían los productos obtenidos al bombardear el uranio con neutrones lentos, pero no identificaron el nuevo proceso de fisión nuclear, que sí entendería perfectamente la física austríaca Lise Meitner.
IRÈNE CURIE

Irène y Frédéric en el laboratorio, en una fotografía tomada hacia 1935.
Irène, al igual que su madre, ganó un premio Nobel compartido con su marido Frédéric Joliot-Curie, el de Química del año 1935, el mismo año en el que Chadwick recibiría el de Física por el descubrimiento del neutrón. Quizá estaba escrito en las estrellas que Irène iba a seguir en todo los pasos de su madre, porque donde se estrelló su madre también se estrelló ella. Frédéric recibió la espada de Académico de manos de su orgulloso maestro, Paul Langevin, en 1945. Sin embargo, la que había sido su mentora en el laboratorio y había compartido el Nobel con él, nunca mereció tal honor, a pesar de que, a diferencia de Marie, Irène lo siguió intentando hasta su fallecimiento en 1956, cuando murió de leucemia, la misma enfermedad que había acabado con su madre.
En 1934, mientras estudiaban los procesos de aniquilación electrón-positrón, detectaron un proceso imprevisto que identificaron como radiactividad artificial. Marie fue la primera persona a la que anunciaron el resultado de su experimento. Inmediatamente se dio cuenta de la relevancia del mismo, pero en lugar de ir directamente al laboratorio donde trabajaban su hija y su yerno, fue a buscar a Paul Langevin a su casa, y juntos vieron la demostración del experimento que los había convertido en alquimistas.
Marie estuvo en el laboratorio hasta que un día de abril de 1934 no se encontró bien. Como los médicos pensaron que podía tener un problema de pulmones, la enviaron a la montaña. Y allí murió en un sanatorio en Sancellemoz el 4 de julio de 1934.
«El combate de la ciencia es el de la razón contra las fuerzas del oscurantismo, el combate de la libertad de espíritu contra la esclavitud de la ignorancia».
—FRANÇOIS MITTERRAND, EN EL DISCURSO PRONUNCIADO EN EL ENTIERRO DE MARIE Y PIERRE CURIE EN EL PANTHÉON.
Tuvieron que pasar sesenta años para que Marie Curie recibiera un reconocimiento oficial por parte del Estado francés. En abril de 1995 los restos mortales de Marie y Pierre Curie fueron trasladados al Panthéon de París, santuario laico donde reposan los restos de los grandes «hombres» de Francia. Fue uno de los últimos actos públicos de François Mitterrand, que presidió el acto junto al presidente polaco Lech Walesa, siendo una de sus protagonistas Ève Curie. El presidente francés destacó la capacidad de trabajo y el ingenio de Marie, su lucha por abrirse camino en un mundo de hombres, y su contribución a la grandeur francesa.
Cuentan que Einstein dijo de Marie que era la única persona a la que la fama no la había corrompido. No fue solo a la fama a lo que no sucumbió: nada consiguió doblegarla. Nunca.